跨入新方向!颜宁团队再发Cell
鞭毛是纤毛或鞭毛上的毛发状侧翼附属物,参与机械感觉和细胞运动,但其组成和结构尚不清楚。
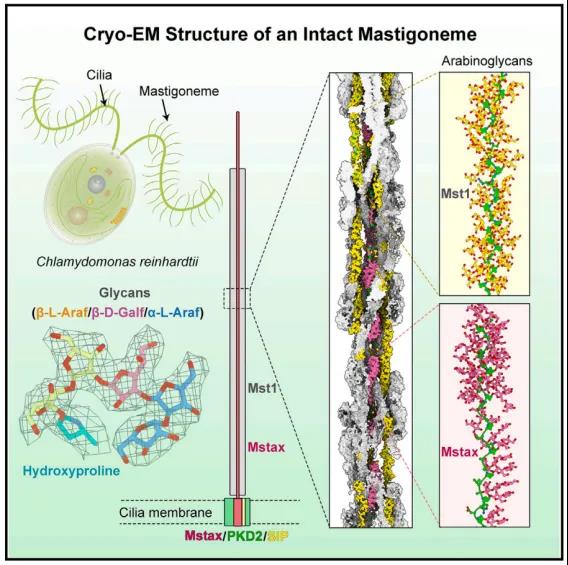
2024年3月28日,清华大学/深圳医学科学院颜宁、清华大学闫创业及潘俊敏共同通讯在Cell 在线发表题为“Structure-guided discovery of protein and glycan components in native mastigonemes”的研究论文,该研究报道了从莱茵衣藻纤毛中分离的天然纤绒毛 (Mastigoneme) 3.0 Å分辨率的冷冻电镜结构。
长茎形成一个超级螺旋,每个螺旋旋转由四对反平行的纤绒毛素样蛋白1 (Mst1)组成。在Mst1中,在II型聚羟基脯氨酸(Hyp)螺旋周围发现了大量阿拉伯糖聚糖,它们代表了植物和藻类中常见的一类糖基化。EM图谱揭示了纤绒毛轴心蛋白(Mstax),该蛋白富含重度糖基化的Hyp,并含有PKD2样跨膜结构域(TMD)。Mstax有近8000个残基,从细胞内区域到纤绒毛素的远端,为Mst1的组装提供了框架。该研究提供了对天然生物结构中蛋白质和聚糖相互作用复杂性的见解。
另外,2024年3月5日,清华大学/深圳医学研究院颜宁团队在Cell Research 在线发表题为“Structural basis for different ω-agatoxin IVA sensitivities of the P-type and Q-type Cav2.1 channels”的研究论文,该研究揭示了不同ω-agagoxin IVA灵敏度的P型和Q型Cav2.1通道的结构基础。该研究报告了Cav2.1单独和与MVIIC或Aga-IVA复合物的冷冻电镜结构,总分辨率为2.9-3.1 Å。这些结构揭示了两种选择性肽毒素选择性抑制Cav2.1的分子决定因素,为亚型特异性治疗的发展奠定了基础(点击阅读)。
2024年2月21日,清华大学/深圳医学科学院颜宁团队在PNAS 在线发表题为“Dissection of the structure–function relationship of Nav channels”的研究论文,为了描述人类Nav通道的结构-功能关系,该研究以人类Nav1.7为原型进行了系统的结构分析。根据野生型(WT) Nav1.7与含有11个突变的变体Nav1.7- M11之间的结构差异,该研究生成了另外三个中间突变体,并以2.9-3.4 Å的总分辨率求解了它们的结构。在孔域(PD)上有9个点突变的突变体被命名为Nav1.7-M9,其空腔体积减小,门密封,所有电压感应域(VSD)保持在上。WT和Nav1.7-M9的结构比较指出了两个可能对PD收紧至关重要的残基。然而,包含这两个突变的变体Nav1.7-M2,甚至与VSD中另外两个突变Nav1.7-M4结合,都未能使PD收紧。该结构分析表明,静态失活I-V曲线的右移与PD收缩的趋势相关。研究人员预测静息状态下的通道应该有一个“紧”的PD和低的VSD(点击阅读)。

纤毛,或鞭毛,突出到细胞外环境服务于双重目的检测环境的变化和促进细胞运动。一些单细胞原生生物的纤毛排列有侧毛,称为纤绒毛。先前的研究表明,纤绒毛可能参与机械刺激的感知。它们还可以通过增加纤毛在蛙泳运动时的有效表面积来增强纤毛推进力。
有管状和非管状纤绒毛。管状纤绒毛属通常长1毫米,直径15-19纳米,相对坚硬,而非管状纤绒毛属较短(0.8毫米),较薄(10纳米),柔韧,易脱落。衣单胞菌纤毛上的非管状纤绒毛素被认为与多囊肾病蛋白(PKD2)(也称为多囊素-2 [PC-2])有关,多囊素-2是一种瞬时受体电位(TRP)家族通道,其跨膜区域共享电压门控离子通道(VGIC)折叠。在哺乳动物细胞的初级纤毛上,PKD2的三个亚基与PKD1(也称为PC-1),(具有巨大的多结构域胞外区域)组合形成异源四聚体。然而,PKD1/PKD2异构体的生理功能尚不完全清楚,该异构体是否具有通道活性仍存在争议。预测衣藻上的纤绒毛是由重度糖基化的纤绒毛样蛋白1 (Mst1)组成的螺旋状聚合物。由于纤绒毛的高分辨率结构的缺乏,完整的组件,准确的组装,以及与PKD2潜在相互作用的细节仍然是未知的。此外,聚糖的结构或功能作用仍然难以捉摸。
糖基化是翻译后修饰(PTM)的一种主要形式,它显著地扩展了蛋白质的结构复杂性和功能多样性。糖化蛋白参与多种生物过程,如信号传导、免疫反应和细胞分化。在核酸、蛋白质、脂质和碳水化合物这四种主要的生物分子中,后两者是结构生物学最具挑战性的目标。糖基化通常通过点突变或去糖基化来去除,以改善基因的均匀性蛋白质结晶。使用单粒子冷冻电镜(cryo-EM)进行结构分析,可以保存糖基化。然而,由于多糖链固有的柔韧性,在EM图中只能分辨出靠近修饰残基的几个糖基。碳水化合物结构信息的缺乏严重限制了人们对一类主要生物分子的理解。
机理模式图(图源自Cell )
为了扩大人们对糖蛋白和天然生物结构的了解,作者利用单粒子冷冻电镜(cryo-EM)研究了莱茵衣藻(Chlamydomonas reinhardtii)内源纤绒毛的组装,并获得了3.0 Å的重建。除了交织在一起的Mst1原纤维的高阶低聚物外,出色的EM图谱还能够鉴定出作为纤绒毛中心轴的蛋白质。研究人员将这种高度糖基化、富含羟脯氨酸(Hyp)的大蛋白命名为纤绒毛特异性轴蛋白Mstax。对Mstax未解析片段的结构预测显示,在近膜区和跨膜区存在PKD2样褶皱,从而为纤绒毛和PKD2之间的相互作用提供了合理的分子基础。该研究提供了对天然生物结构中蛋白质和聚糖相互作用复杂性的见解。
清华大学讲席教授、北京生物结构前沿研究中心研究员、深圳医学科学院创始院长颜宁,清华大学生命科学学院副教授、北京生物结构前沿研究中心研究员闫创业,清华大学生命科学学院教授潘俊敏为本文的共同通讯作者。清华大学生命科学学院2022级直博生黄隽豪、2018级直博生陶慧和2022级直博生陈继坤为本文共同第一作者。清华大学生命科学学院2020级本科生沈扬参与了本研究。清华大学冷冻电镜平台主管雷建林教授为电镜数据收集提供了帮助。实验的质谱鉴定工作得到了蛋白质化学与组学平台的支持,实验的计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)的支持。本研究得到了科技部重点研发计划,国家自然科学基金重大研究计划、面上项目、专项项目,膜生物学国家重点实验室,北京市科技新星计划,北京高校卓越青年科学家计划项目,北京生物结构前沿研究中心与清华-北大生命科学联合中心的经费支持。
赞一个
- 文章标签:
- 高校动态
更有众多热门

















