肿瘤治疗的新突破!光热免疫协同纳米药物研发成功
近日,Xi交通大学第二附属医院肿瘤内科与Xi交通大学生命科学与技术学院仿生工程与生物力学中心、香港科技大学唐本忠院士团队、Xi交通大学第一附属医院消化内科在肿瘤光热免疫疗法领域取得重要进展。相关研究成果发表在生物医学和工程技术领域的权威期刊《生物材料》上(Biomaterials)。
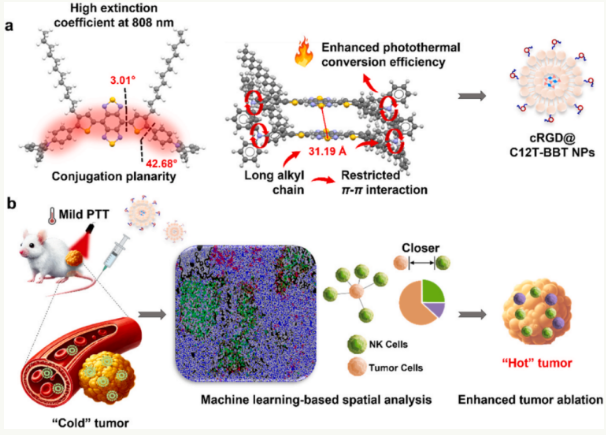
团队成功开发了新的近红外两区聚集,诱导发光(NIR-II AIE)分子 C12T-BBT,因此,纳米药物CRGD@C12T以这种分子为主体生成-BBT。当红外线激起时,cRGD@C12T-BBT能带来温和的光热效果(PTT),有效筹集资金,激活肿瘤局部自然杀伤细胞(NK),然后引发免疫反应(PIT)。此外,团队创新性地整合了新的空间分析技术和生物技术,系统地分析了肿瘤微环境中NK细胞的空间组学特征和生物学机制。研究发现,cRGD@C12T-BBT具有PTT/PIT协同作用的多功能优势,具有显著的临床转化实用价值,能实现诊疗一体化。
团队使用DSPE-PEG和生物相容性好的两亲聚合物DSPE-PEG-MAL,封装C12T-BBT,构建纳米颗粒;使用CRGD肽进行装饰,以提高肿瘤位置的主动靶向聚集能力。CRGD@C12T这种新型纳米药物-BBT,它不仅具有优异的光热性能,而且具有良好的稳定性和生物相容性;此外,它还可以实现NIR-II区域肿瘤实时成像和PTT/PIT协同治疗的多功能集成。因此,它在肿瘤的即时判断和精确治疗中具有重要的应用价值。
研究表明,温和光热治疗(43℃-45℃)可以显著改善NK细胞和肿瘤细胞的空间布局,同时局部加热和杀死肿瘤细胞,从而提高NK细胞的杀伤效率。此外,研究团队首次通过使用机器学习辅助的新空间分析技术,揭示了温和光热治疗对肿瘤免疫微环境的重塑作用,为机制探索提供了新的视角。
赞一个
更有众多热门

















