研究表明,ASB7扩增会导致基因组不稳定
中山大学肿瘤预防控制中心研究员康铁邦和副研究员武远众的团队研究表明,ASB7的扩张会导致基因组不稳定,并给肿瘤PARP抑制剂(PARPi)敏感性。这一发现可能为未来ASB7扩增型肿瘤患者提供新的治疗思路,相关成果于5月30日在《科学》上发表。(Science)。
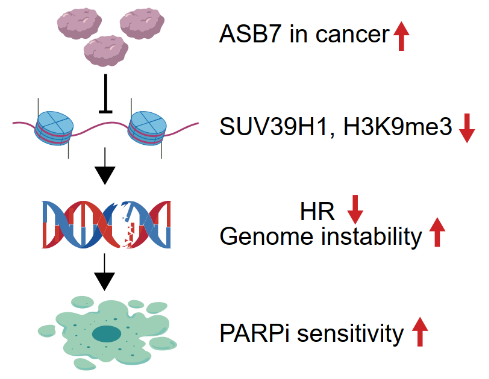
H3第9位赖氨酸三甲基化(H3K9me3)在维持异染色质结构、基因沉默和DNA损伤修复方面发挥着关键作用。H3K9me3的不平衡会导致基因组的不稳定和癌症的发展。H3K9me3的建立依赖于阅读器HP1对现有修饰品的识别,从而征集书写器甲基转移酶SUV39H1。后者通过甲基化相邻组蛋白形成“读写”的正反馈循环。为了避免H3K9me3的过度沉积和异染色质的异常形成,必须严格控制这一过程,以避免前细胞损伤。
通过选择CRISPR-Cas9遗传学,研究团队发现E3泛素连接酶ASB7是H3K9me3的关键负调节因素。在调节机制方面,H3K9me3的读者HP1可以从ASB7到异染色区域招募降解SUV39H1,这一过程受到细胞周期激酶CDK1的影响-Cyclin B1受到严格控制。进入丝分裂M期后,CDK1磷酸化ASB7阻断了其对SUV39H1的泛素化降解,并确保了H3K9me3在随后的细胞周期中的重建。研究发现,“读写降解”平衡可能是H3K9me3保持表观遗传稳态的基本机制,而不是经典的“读写擦除”平衡,在哺乳动物细胞(包括肿瘤细胞)中。
H3K9me3装饰将出现在DNA双链断裂损伤点,从而激活下游级联损伤修复通道。ASB7在各种肿瘤中呈现扩张状态,导致H3K9me3装饰水平不足,导致同源重组修复受损。细胞和动物实验表明,ASB7的高表现增强了肿瘤细胞对PARP抑制剂的敏感性。这提醒:ASB7扩张性肿瘤患者可能是PARP抑制剂的潜在受益者。
赞一个
更有众多热门

















