新型自控智能工程菌系统可精确靶向定植肿瘤组织
研发家
|
2025-06-11
33
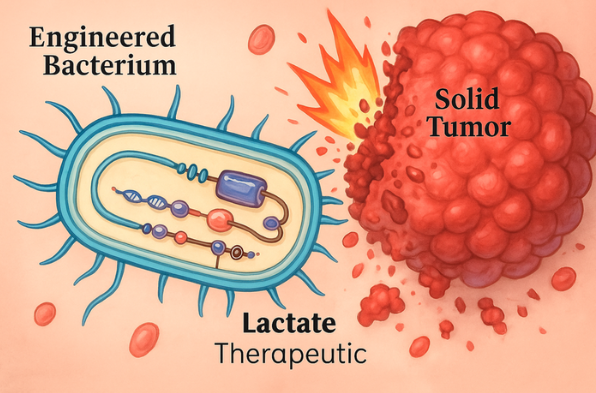
华东理工大学教授叶邦策和周英团队建立了基于肿瘤微环境响应的自控智能工程细菌系统,完成了肿瘤组织的精确靶向种植,建立了治疗负荷的可控释放系统,为肿瘤的精准高效治疗提供了新的工具。最近,相关研究发表在《先进科学》中。
工程细菌凭借其选择性定植肿瘤组织的能力和高度可编程的特点,在肿瘤治疗领域具有显著的应用潜力。但为了实现工程细菌的临床转化,仍然需要处理一些瓶颈问题,包括药物释放的准确性和效率,以及在肿瘤组织中定植的时间和空间的准确控制,以及通过血管泄漏治疗蛋白质的预防机制。
研究小组开发了一种新型乳酸调节元件和传感器,不受葡萄糖等肿瘤微环境的抑制,使工程细菌能够准确响应肿瘤组织的乳酸浓度,并将“感知-响应-繁殖”的基因回路连接起来,使工程细菌只能在肿瘤微环境中生存。实验结果表明,工程细菌组织的目标分离减少了2-3个量级,最大耐受剂量增加了3倍。
此外,研究人员还引入了基于群体感应的工程细菌。α-溶血素自我调节释放回路。另外,在高水平乳酸环境下,工程细菌产生凝结酶(Coa),从而诱导肿瘤中的血栓形成。血栓剥夺了肿瘤的营养和氧气供应,诱发了肿瘤代谢的重新编程,从而提高了工程细菌的抗肿瘤效果。此外,肿瘤中的堵塞降低了细菌和毒性蛋白质泄漏的风险。
在此基础上,研究人员建立了结直肠癌荷瘤小鼠模型,并进行了体内实验。该工程活菌药物的肿瘤抑制率达到90%,显著延长了小鼠的生存时间。
赞一个
33
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权
最新文章
NEW
热点资讯
HOT
学术资源免费领取
加微信领取20G科研大礼包!
更有众多热门
更有众多热门

















