研究人员发现甲氨蝶呤抗肿瘤新用途及新机制
中国科学院上海药物研究所(以下简称上海药物研究所)研究员郑明月、副研究员张素林团队联合盐城市第一人民医院主任医师耿炜团队,揭示了甲氨蝶呤抗肿瘤免疫作用的经典免疫抑制药机制,为肿瘤免疫治疗和放疗在临床实践中的联合应用提供了理论依据。6月4日,《科学转化医学》发表了相关研究。
近几年来,肿瘤免疫治疗取得了重大突破,但是原发性和继发性耐药性仍然存在。cGAS-在肿瘤微环境中,STING通道激活可以诱导免疫细胞渗透和抗原呈递,提高免疫疗法的敏感性。但是,STING蛋白在全身组织中得到了广泛的表达,如果直接使用STING激动剂,可能会导致全身免疫毒性。
过去的研究发现,外核苷酸焦磷酸酶/磷酸二酯酶1(ENPP1)可以通过水解cGAMP对STING信号进行负向调节,并且在各种肿瘤组织中得到高度表达。所以,选择性抑制ENPP1有望激活肿瘤微环境特异性STING信号,防止全身免疫毒性反应。
此前,中国科学院教授、上海药物研究所研究员蒋华良团队与郑明月团队合作开发了一种双生谱图卷积网络,利用微扰转录组数据预测药物-目标相互作用(SSGCN)算法,利用该算法预测甲氨蝶呤具有ENPP1抑制作用。研究中提到的甲氨蝶呤是一种经典的抗代谢抗肿瘤药物,也是一种免疫抑制剂和抗风湿药物,广泛应用于治疗多种癌症、自身免疫性疾病和皮肤病。
研究小组在早期研究的基础上,进一步揭示了甲氨蝶呤在肿瘤微环境中以前没有被认识到的免疫激活功能。研究表明,甲氨蝶呤可以选择性地诱导肿瘤细胞DNA损伤,cGAS-同时,STING通道激活和cGAMP生成可以抑制ENPP1介导的外部cGAMP水解和腺苷生成,从而显著增强树突状细胞的渗透,促进CD8。活化T细胞。
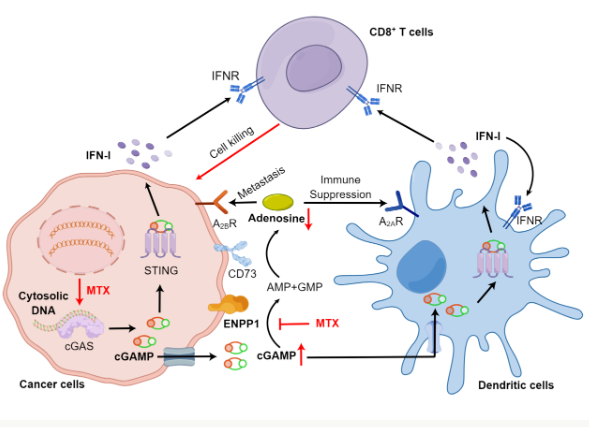
此外,在小鼠模型中,小剂量甲氨蝶呤的治疗显著提高了免疫治疗和放疗的抗肿瘤效果,解决了肿瘤对免疫检查点阻断治疗的抗药性。在最初的临床试验中,研究小组也观察到了类似的增效效果。
研究小组表示,这一发现不仅为甲氨蝶呤联合放射治疗或免疫治疗提供了理论依据,而且开发了针对ENPP1/DNA损伤双重途径的新型抗肿瘤药物研发理念,具有重要的临床转化价值。
赞一个
更有众多热门

















