不对称催化新突破!中国科学家开发了高效合成手性双环内酰胺的策略
近日,西北A&F大学化学与药学院教授谢卫青团队在金属过渡不对称催化领域取得重大突破,ACS在线发布相关研究成果。在Catalysis上。该研究首次报道了不对称串联氮杂环丙烷化/氮杂环丙烷化半频哪醇重排反应,成功实现了双环内酰胺类化合物的高效、高对比选择性合成,含有季碳三维中心。该反应通过精确控制手性配体,显示出优异的立体控制能力,为复杂的天然产品和药物分子的结构装饰和合成提供了新的策略。
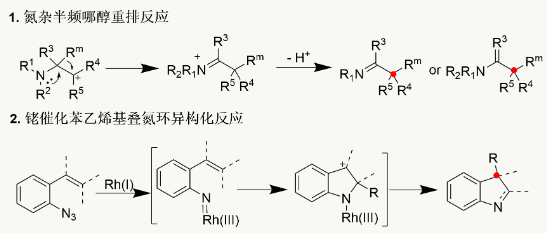
氮杂物半频哪醇重排反应?(Aza-semipinacol rearrangement)通过氮β-碳正离子的形成及其后续的形成α-位取代基1,2-迁移过程,为构建季碳立体中心的重要策略。然而,该反应的不对称催化研究仍处于起步阶段,相关报道极为有限。近年来,金属氮宾化学的发展为这一领域注入了新的活力。例如,铑催化的苯乙烯基叠氮环异构化反应虽取得一定进展,但仍存在底物范围狭窄、对映选择性控制尚未实现等显着局限性。在此背景下,如何发展高效的手性催化体系,实现氮杂物半频哪醇重排反应?的立体选择性调控,特别是用于构建含季碳中心的手性双环骨架,仍是当前有机合成领域亟待解决的关键科学难题。
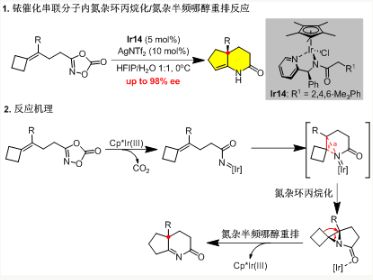
这个课题组开发了Cp*Ir(III)催化烯基1,4,2-二恶唑-5-酮的不对称串联分子内氮杂环丙烷化/氮杂半频哪醇重排反应,以易于制备的烯基二恶唑酮为原料,高效构建含季碳三维中心的双环氮杂环骨架。经过系统筛选发现,手性苯基(吡啶-2-基)甲胺配体,用2,4,6-三甲基苯基乙酰基装饰,可诱导最佳的映射选择性(高达98% ee),为环戊[b]吡啶-2-酮类化合物的精确合成提供了一个普遍的解决方案。机制研究表明,这种反应经历了三个关键步骤:Ir-酰基氮烯中间体形成、分子内氮杂环丙烷化和后续氮杂半频何醇重排。DFT计算为这一反应路径提供了理论支持。
赞一个
更有众多热门

















