科学家破译精神分裂症遗传-新的环境互动机制
6月6日,西安交通大学第一附属医院精神科马现仓和高媛团队在精神领域期刊《大脑、行为和免疫》上刊登了《大脑》(Brain Behavior and Immunity)本文首次建立了Nod2缺失和母体免疫激活的双重攻击模型,进一步揭示了肠道菌群-免疫-脑轴在精神分裂症发生和发展中的关键机制。
精神分裂症是一种严重的精神障碍,全球发病率约为1%,是世界十大致残原因之一。过去,许多研究表明,遗传、环境、肠道菌群等因素是导致精神分裂症的关键原因,但其具体的分子机制尚不清楚。
该团队的早期研究发现,精神分裂症的发生与肠道微生物紊乱有关。肠道生态紊乱导致肠道衍生细菌产物向体循环的转移增加,促进与精神分裂症相关的炎症和其他生理异常。细胞壁酰二肽是肠道细菌的产物(MDP)它是精神分裂症患者免疫激活的上游介质之一。作为细胞中的模式识别受体,Nod2可以特别识别MDP,启动信号级联,释放炎症介质,支持早期宿主防御和免疫调节。因此,Nod2受体被称为“肠道守门员”,是维持肠道菌群和宿主免疫反应平衡的关键分子。此外,Nod2在肠道和大脑中被广泛表达。它是调节肠道和大脑轴的关键因素,也是深入了解肠道菌群如何在远离大脑的情况下发挥作用的重要突破。
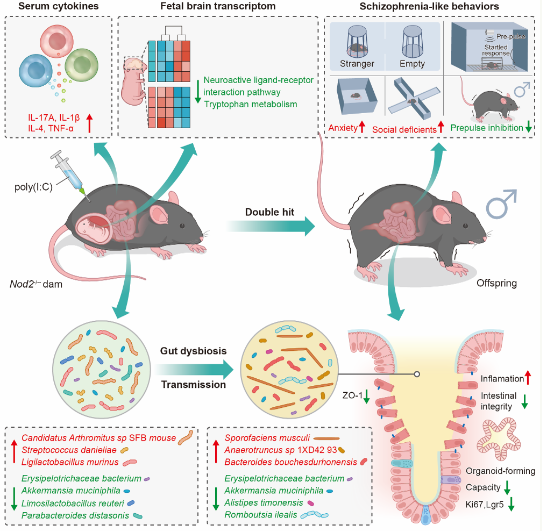
怀孕期间母体免疫激活(MIA)MIA被认为是精神分裂症的一个重要风险因素,因为它会破坏母亲和胎儿环境之间的微妙平衡,导致子代的持续免疫变化、神经发育障碍和行为异常。然而,并不是所有的母亲感染都会导致子代出现精神分裂症或相关疾病。“遗传缺陷”可能会使个人更容易感染MIA,从而导致子代出现更严重的精神分裂症相关表型。早期研究发现,Nod2在精神分裂症患者中受到反应性损害,但其对精神分裂症的影响机制仍不清楚。因此,该团队建立了Nod2-------
研究发现,Nod2基因缺陷和怀孕期间免疫激活的双重暴露可能导致男性子代精神分裂症,并伴有大脑发育异常、肠道屏障损伤和微生物群紊乱。宏基因组分析进一步证实,母体肠道菌群紊乱可以通过垂直传播影响子代,从而增加子代神经发育障碍的风险。机制研究表明,这一过程涉及肠道完整性损伤、肠道器官形成能力损伤、神经递质信号异常和胎儿大脑基因表达谱的显著变化。
赞一个
更有众多热门

















