中山大学宋尔卫院士、苏士成团队最新Nature及多篇论文,被质疑!
研发家
|
2024-02-02
0
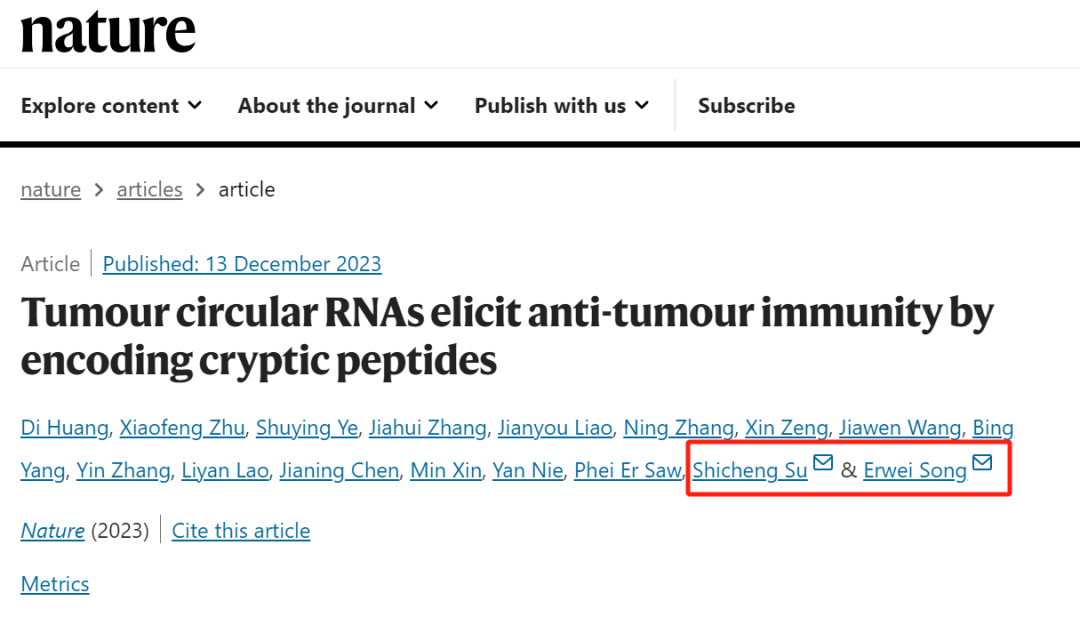
继中山大学二院乳腺外科课题组集体患癌事件及后续一系列骚操作发生后,宋尔卫、苏士成一直处于风口浪尖。
这篇Nature 论文发表后,在学界也引发了不小的热议,文章发表的当月,就有人在PubPeer网站发文,对该研究的方法和结果提出了质疑。
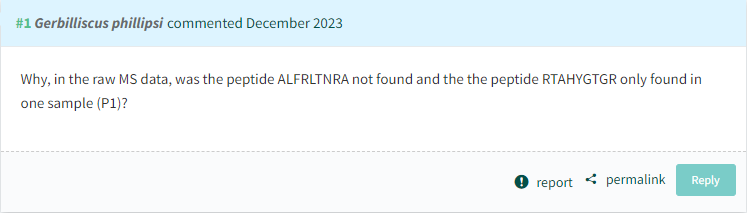
不仅如此,在此这篇之前,就有网友整理,在PubPeer网站上,宋尔卫院士已有8篇一作/通讯论文(2003年-2023年)被质疑造假:

图源:PubPeer
此外,他们还指出,合成的circFam53b IVT起始序列“AAAA”与T7 RNA聚合酶偏好的“GG”转录起始序列相悖。评论者还提到,合成circRNA的数据完全缺失,包括凝胶分析、质量检查和IVT模板序列,这被认为是不专业和不可接受的。
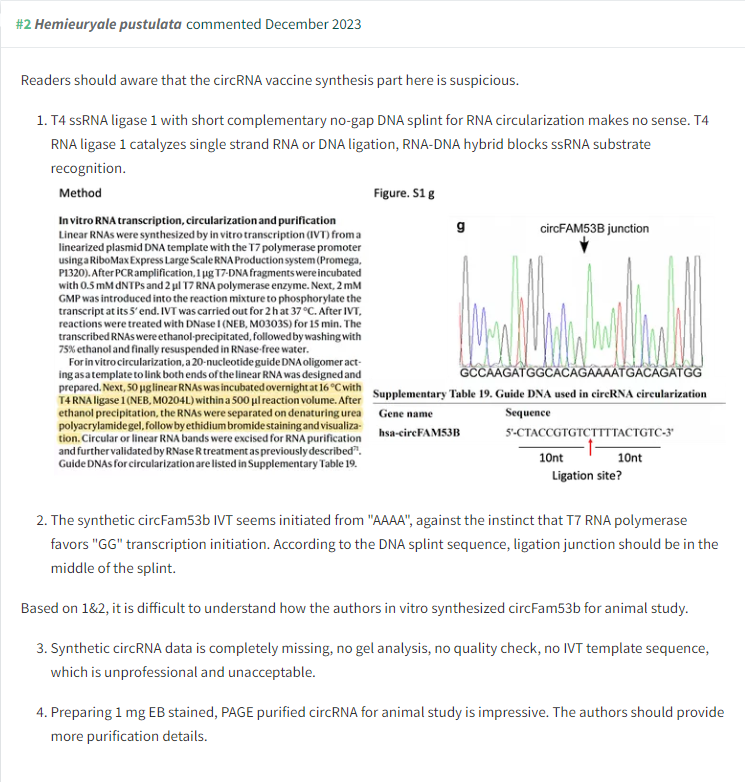
他们指出,即使是NEB网站也显示,该酶无法在完全互补的RNA-DNA杂交体中催化ssRNA末端的镍连接。另外,他们还提到,作为连接指南的DNA寡核苷酸实际上应该阻止上述的环状RNA的产生。

图源:PubPeer
赞一个
1
- 文章标签:
- 学术不端与撤稿观察
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权
最新文章
NEW
热点资讯
HOT
学术资源免费领取
加微信领取20G科研大礼包!
更有众多热门
更有众多热门

















