研究表明,抗肿瘤潜在药物介导铁死亡传递。
近日,中山大学肿瘤防治中心研究员朱孝峰/邓蓉团队发现半乳糖凝聚素-13(Galectin-13)Galectin-13是介导肿瘤细胞铁死亡传递的关键因素,并揭示了Galectin-13通过弱化溶质媒介家族7成员11(SLC7A11)质膜定位,提高了相邻肿瘤细胞铁死亡的敏感性,从而导致铁死亡传播。《自然-化学生物学》在线发布了相关成果。
铁死亡是由脂质过氧化驱动的过程化细胞死亡模式。铁死亡在肿瘤的发展中起着重要的作用。近年来的研究表明,诱导铁死亡是一种极具潜力的肿瘤治疗方法。细胞铁死亡有几个特点,其中一种是死亡的爆发性,即一旦大规模细胞在短时间内开始死亡,原因是朱孝峰和邓蓉团队早期发现的人类蛋白激酶C-βII(PKCβII)介导脂质过氧化反馈扩大。
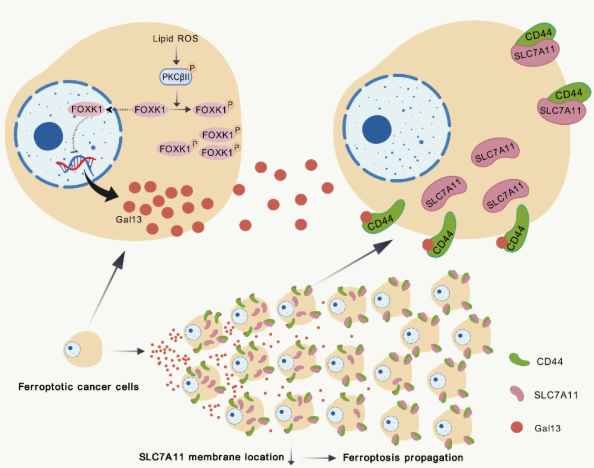
铁死亡的另一个显著特征是死亡的传播,这体现在细胞死亡从局灶向外波浪的传播上。铁死的传播不仅在体外细胞中观察到,在与体内铁死相关的生理和疾病过程中也观察到,体现在大量持续的细胞死亡或组织损伤中。这提醒铁死传播在铁死相关的生理和病理过程中起着关键作用。然而,铁死传递的分子机制尚不清楚。澄清铁死传播的机制将为铁死相关的疾病机制和肿瘤治疗提供新的思路。
针对这一科学问题,研究团队发现,Galectin-13是介导细胞铁死亡传递的关键因素,其模型是肿瘤细胞,利用分泌组学、磷酸化组学和活细胞成像。分子机制的研究发现,在肿瘤细胞铁死亡过程中,铁死亡感受器PKC是铁死亡的肿瘤细胞。βII感应脂质过氧化激活,PKC激活。β促进Galectin-13分泌的II磷酸化FOXK1,Galectin-SLC7A11的质膜定位通过与相邻肿瘤细胞膜上的CD44结合来减弱,从而增强相邻肿瘤细胞的铁死敏感性,进而引导肿瘤细胞的铁死传播。
研究人员还讨论了Galectin-13引导的铁死传播在肿瘤治疗中的作用。通过功能实验和相关分析以及各类肿瘤细胞中的异种移植瘤模型,揭示铁死传播是一种新的调整肿瘤细胞铁死亡敏感性的方法。发现Galectin-13可以有效增强铁死亡耐受性肿瘤对铁死亡诱导剂的敏感性,并提醒干扰Galectin-13可以为基于铁死亡的肿瘤治疗提供新的策略。
最后对Galectin-13-CD44复合物形成的结构基础进行了深入分析,从而产生了模拟多肽。通过模拟Galectin-13的功效,Galectin-13模拟肽可以促进铁死传播,显著提高肿瘤对铁死诱导剂、放射治疗和免疫治疗的敏感性。结果表明,肿瘤干细胞对Galectin-13模拟肽和铁死诱导剂的联合治疗非常敏感。
这种多肽在体内外模型中表现出高效、微毒等优点,具有很强的发展前景。
赞一个
更有众多热门

















