科学家们揭示了激活前列腺素PGE2受体的关键机制
研发家
|
2025-05-23
21
中国科学院上海药物研究所研究员徐华强和徐有伟团队成功分析了人类前列腺素E2(PGE2)及其受体EP1和异源三聚体GQ蛋白复合物的高分辨率结构,揭示了PGE2识别和激活EP1受体的分子机制。相关研究成果最近在美国国家科学院院刊上发表。
PGE2是一种来自花生四烯酸代谢的内源脂质分子,通过结合EP1-EP4四种亚型G蛋白偶联受体,参与炎症反应、血管舒张、疼痛感知等多种生理过程(GPCRs)发挥作用。尽管EP2、EP3和EP4、PGE2和G蛋白的复合结构已经相继分析。由于其结构多变性,EP1受体从未获得高分辨率结构,这严重限制了对其信号系统的深入理解。
为了解决这个问题,研究小组利用冷冻电子显微镜技术获得了2.55分辨率 ?系统分析了PGE2被EP1识别并激活下游信号的通道,其人源PGE2-EP1-GQ复合物的三维结构。分析数据显示,在激活EP1的过程中,第六跨膜螺旋(TM6)的位移幅度明显低于其他亚受体,提醒其具有独特的构象变化和激活方法。
进一步研究发现,EP1在与GQ蛋白偶联时,在前列腺素家族中表现出一种传统而特殊的方式。研究小组在GQ偶联中确定了11个高度保守的关键残留基础。同时,研究发现,在不同受体之间的偶联机制中,EP1有残留基础,不参与GQ的相互作用。
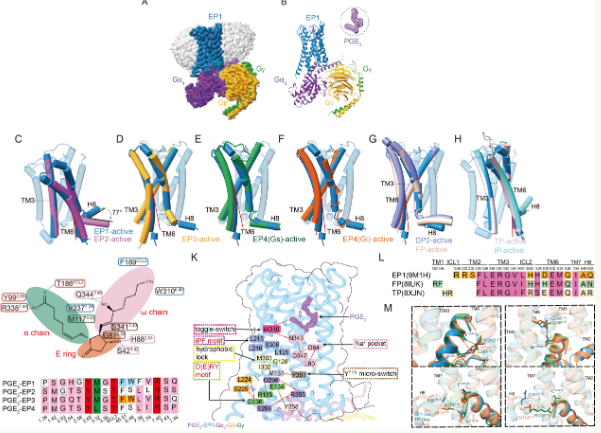
研究小组表示,这项研究不仅首次揭示了EP1受体激活和GQ偶联的3D结构图,改善了前列腺素受体家族结构的信息,而且为未来开发高选择性的EP1药物提供了理论依据。
赞一个
19
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权
最新文章
NEW
热点资讯
HOT
学术资源免费领取
加微信领取20G科研大礼包!
更有众多热门
更有众多热门

















