中文署名,作者仅2人,中国长城登上顶刊封面
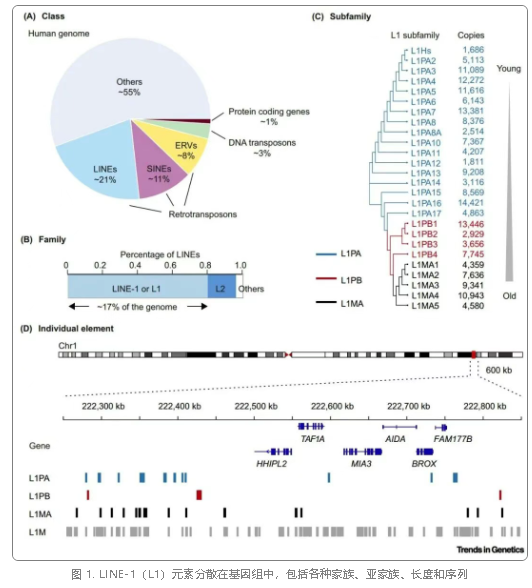
转座子(Transposable Elements)是基因组中可移动的 DNA 序列,被称为「跳跃基因」,其活动驱动基因组进化,但也可能引发基因突变。逆转录转座子通过「复制-粘贴」机制,将 RNA 逆转录为 DNA 后插入基因组新位点,是基因组多样性与不稳定的双重来源。其中,LINE-1(L1)是人类基因组中唯一具有自主转座能力的逆转录转座子,占基因组约 17%。尽管绝大多数 L1 因序列截短或表观沉默而失活,但少数活跃拷贝的异常表达与癌症、神经退行性疾病、衰老等密切相关。解析 L1 的调控机制与功能,对理解生命调控和开发疾病治疗策略意义重大。
近日,清华大学生命学院刘念课题组在遗传学领域的顶级综述期刊《遗传学趋势》(Trends in Genetics)发表题为「人类基因组中 LINE-1 的调控与功能进展」(Advances in understanding LINE-1 regulation and function in the human genome)的封面综述文章,系统总结了 L1 的多层次调控网络及其在生理与病理中的双重角色。文章从表观遗传、转录调控、RNA 加工到整合限制的 L1 全生命周期视角,阐明 L1 如何被精确控制;同时深入探讨了 L1 作为「基因调控工具箱」的功能 —— 通过转录依赖的增强子、启动子及染色质结构元件,影响胚胎发育、癌症演进、免疫应答和衰老进程。


(文章封面:LINE-1 元件约占人类基因组的 17%,显著影响基因组结构和基因表达,影响胚胎发育、衰老、癌症和其他疾病等关键过程。封面插图将 LINE-1 比喻为长城,突出其在界定不同基因表达程序中的作用。长城两侧的对比视图展现了 LINE-1 插入所驱动的多种基因组变化。)
清华大学生命科学学院、清华-北大生命科学联合中心刘念副教授为本文的通讯作者。清华大学生命学院 2019 级博士生李秀峰(已毕业)为该论文第一作者。
LINE-1(L1)元件广泛分布于人类基因组中,涵盖多种家族、亚家族、长度和序列类型。逆转录转座子(包括 L1、L2 长散在核元件、短散在核元件 SINEs 以及内源性逆转录病毒 ERVs)和 DNA 转座子共同占据人类基因组的约 43%,而蛋白质编码序列仅占约 1%。其中,L1 元件占基因组的约 17%,并被分类为 L1PA、L1PB 和 L1MA 亚家族。
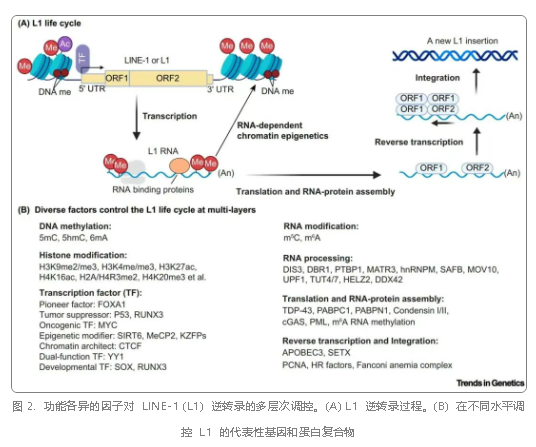
L1 的活性受到严格而复杂的调控。在表观遗传层面,DNA 甲基化和组蛋白修饰(如 H3K9me3 和 H3K27ac)通过沉默或激活染色质状态,维持 L1 的动态平衡。转录因子如抑癌蛋白 p53 和 KRAB 锌指蛋白(KZFPs)直接结合 L1 启动子区域,抑制其转录;而宿主与 L1 的「进化军备竞赛」则驱动了调控机制的持续更新。在 RNA 层面,L1 RNA 上的 m6A 修饰影响 L1 的转录;MOV10 和 TUT4/7 等 RNA 结合蛋白通过降解 L1 RNA 或抑制剪接限制其转座潜力。在逆转录整合层面,APOBEC3 家族蛋白则通过诱导逆转录过程中的突变进一步抑制 L1 活性。此外,DNA 修复通路(如 Fanconi 贫血复合物)通过切割 L1 插入的中间产物,在整合阶段限制其基因组破坏效应。
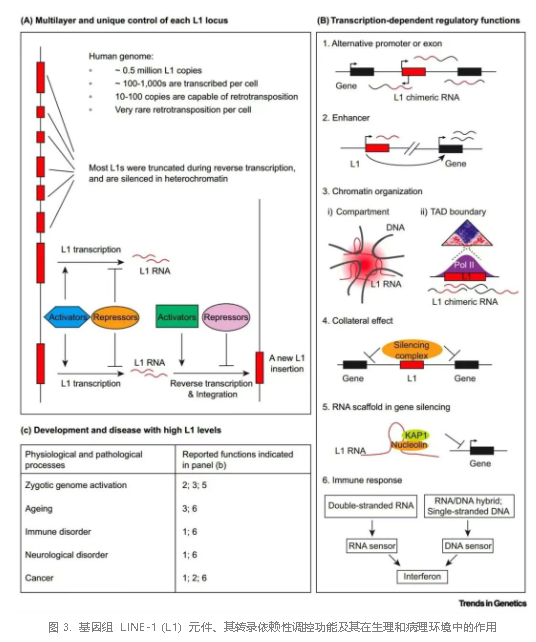
L1 不仅是基因组的「寄生者」,更进化出多样的顺式调控功能。进化上年轻 L1 的 5' UTR 可充当增强子,通过远程染色质互作激活胚胎发育关键基因的表达,尤其在合子基因组激活(ZGA)中发挥核心作用。进化上年老的 L1 则通过与核基质蛋白(如 SAFB)结合,参与染色质三维结构的组织,形成拓扑关联域(TAD)边界,影响基因组结构。此外,L1 衍生的嵌合 RNA 能够作为长非编码 RNA 脚手架,招募 KAP1 等沉默复合体,调控 X 染色体失活和神经发育。这些功能揭示 L1 已深度融入宿主的基因调控网络。
L1 在生理与病理背景下具有双重作用。在胚胎发育早期,L1 通过增强子活性启动合子基因组激活,随后通过 RNA 介导的染色质沉默确保发育进程有序退出。然而,在癌症中,L1 的异常插入可能破坏抑癌基因(如 APC),驱动肿瘤发生;另一方面,L1 可以与周边基因形成嵌合转录本,产生肿瘤新抗原,这有助于癌症靶向治疗的发展;其激活的免疫应答(如 cGAS-STING 通路)又可能抑制肿瘤进展,凸显其双重角色。在衰老过程中,L1 的去抑制导致慢性炎症和基因组不稳定,而靶向 L1 的反义寡核苷酸可逆转部分衰老表型。神经退行性疾病如共济失调和雷特综合征中,L1 的异常活动通过 DNA 损伤和免疫通路加剧神经元退化。
L1 的调控与功能仍存在诸多未解问题。例如,不同调控因子如何在特定细胞状态下动态协作或竞争以平衡 L1 活性?RNA 修饰(如 m6A 和 m5C)如何时空特异性地影响 L1 的转录与转座?L1 如何精确选择远端基因作为染色质互作靶标?此外,L1 衍生物(如 ORF1 蛋白)能否作为跨癌种的早期诊断标志物?其激活的免疫应答如何优化以提高癌症治疗效果?
未来研究需结合单细胞多组学、高通量基因编辑和人工智能模型,揭示 L1 在发育与疾病中的动态调控网络。开发靶向 L1 的反义寡核苷酸、表观药物或免疫疗法,有望为癌症、神经退行性疾病及衰老相关疾病提供全新治疗策略。随着技术革新,L1 这一曾被视为「基因组寄生虫」的元件,正逐步展现出其作为生命调控核心参与者的复杂魅力。
原文链接
https://doi.org/10.1016/j.tig.2025.04.011
赞一个
更有众多热门

















