微真核基因编辑新工具研发成功,基因治疗与繁殖有新技术
与过去相比,平均编辑效率提高了11倍,将为基因治疗和动植物生物育种提供全新的技术解决方案。这是西北A&F大学羊遗传改良与生物育种团队联合国内多家单位开发的微型真核基因编辑工具enNlovFz2的辉煌成果。5月20日,国际学术期刊《自然化学生物学》发表了一篇关于这种新工具的研究论文。
基因是遗传信息的载体,创造了生命的多样性和复杂性。基因编辑是理解和改造生命的核心技术,为人们处理许多领域的问题提供了新的思路和方法。基于经典基因编辑系统的CRISPR及其衍生技术广泛应用于功能机制研究、基因治疗和动植物繁殖等领域。然而,大多数CRISPR蛋白质尺寸较大,难以实现单腺相关病毒AAV的包装和传递,从而限制了其在生物中的编辑效率。
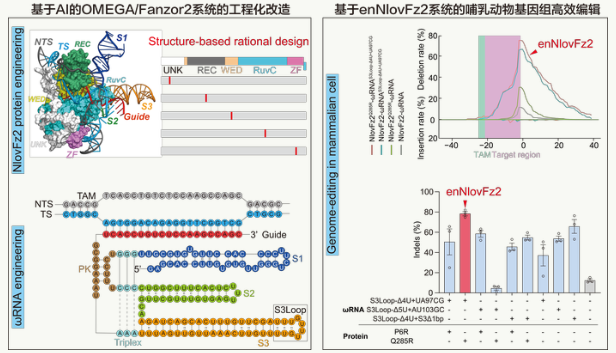
近年来,RNA(核糖核酸)引导的微型基因编辑工具相继被发现,推动了基因编辑工具进入“微型化”时代。基因编辑领域的先驱张锋团队发现了一种新型的RNA导向核酸酶,将其命名为“OMEGA系统”,并确认来自真核生物的Fanzor蛋白可以靶向插入和缺乏编辑人类基因组的特定位点。Fanzor不同于来自原核生物的CRISPR/Cas系统,理论上可以降低动物体内不必要的免疫反应,具有较低的保真性。
基于人工智能的RNA结构调整、蛋白质工程化改造、流式细胞术、全基因组脱靶检查等,西北农林科技大学羊遗传改良与生物育种团队首次对Fanzor家族NlovFz2–ω优化RNA系统,开发出一种基于Fanzor蛋白工具改造的新型微型真核基因编辑工具enNlovFz2。
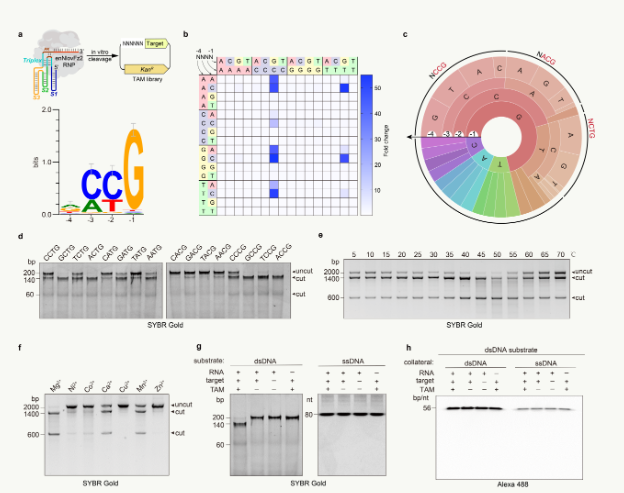
该团队使用该工具有效地编辑了人类基因组的26个目标点,其插入-删除效率高达81.2%,比原版本的平均编辑效率提高了11倍(图1)。相关实验表明,与过去相比,该工具可以识别广泛的基因序列(图2)。该团队使用该工具成功准备了小鼠白化病模型,两个编辑位点的编辑效率分别达到38.3%和48.7%。与此同时,在人源化杜氏肌的营养不良中(DMD)在小鼠疾病模型中,该工具成功高效地将小鼠肌纤维中肌萎缩蛋白水平恢复到野生小鼠的20%,显示出广阔的应用前景。
这种来自真核生物的新工具丰富了基因组编辑的迷你核酸酶工具箱,为基因治疗和动植物生物育种提供了高效的替代工具。
西北A&F大学教授王小龙、副教授徐坤、上海科技大学副研究员吴兆邈是论文的通讯作者。他教授魏迎辉、博士生高鹏飞、研究生陈宇斐、上海科技大学潘登博士、中国科学院药物研究所副研究员李国玲是论文的共同第一作者。这项研究获得了农业生物育种、国家自然科学基金、中国现代农业产业技术体系等重大专项资助。
赞一个
更有众多热门

















