利用AI驱动的新研究平台发现了新的小分子抑制剂
借助人工智能,英国硅智能研究团队(AI)目标发现平台PandaOmics和生成化学平台Chemistry42,设计了一种新型的ENPP1小分子抑制剂,该分子在临床前模型中被证明能够更高效、更安全地调整cGAS-STING通道,显示出创新免疫治疗策略的广阔前景。五月二十三日,《自然-通信》发表了相关研究。
免疫检查点抑制剂的出现给肿瘤治疗带来了革命性的变化,使许多恶性肿瘤患者获得了显著的临床利益。然而,目前只有10%到35%的患者接受免疫检查点抑制剂治疗,他们可以获得持久而显著的治疗反应,迫切需要开发更具创新性和有效性的治疗策略。
cGAS-STING通道是连接自然免疫和适应性免疫反应的关键桥梁,激活后可诱导肿瘤细胞凋亡和细胞周期阻滞,从而有效抑制肿瘤的发生和早期进展。它是肿瘤免疫治疗领域备受关注的新型治疗目标。然而,成功将cGAS-STING通道的生物机制转化为安全有效的治疗方法仍然面临许多挑战。
为了解决这个问题,核苷酸焦磷酸酶ENPP1是研究团队之外的突破口。此前的研究表明,靶向ENPP1可以准确控制肿瘤中的通过STING通道,可以实现有效且可控的抗肿瘤免疫。
在PandaOmics平台的基础上,研究小组系统地识别和排序了与ENPP1失衡相关的适应症,发现三阴性乳腺癌(TNBC)、肝细胞癌(HCC)、ENPP1显著表现为急性髓性白血病等多种癌症。进一步分析结果表明,结合ENPP1抑制剂和免疫检查点抑制剂以及具有DNA损伤功能的化疗药物,是一种潜在的治疗策略,值得探索。
研究小组以已知的ENPP1抑制剂为起点,采用Chemistry42基于结构的药物设计。(SBDD)方法,从零开始生成创新化合物,只用了3个月就有效地获得了一系列的苗头化合物分子。经过多轮优化和迭代,研究人员对ISM5939进行了筛选,具有良好的ENPP1抑制选择性和效果。
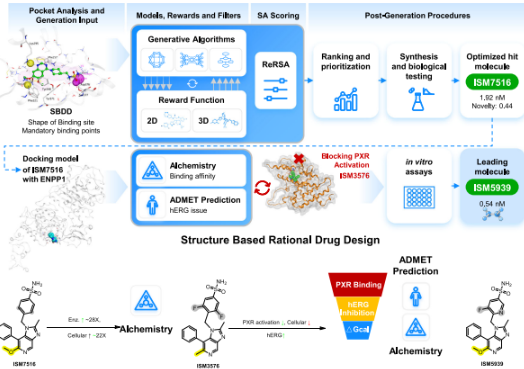
根据临床前的数据,ISM5939在联合使用多种疗法时疗效显著,与抗PD-1疗法、化疗、PARP抑制剂等联合使用时,疗效均有所提高。另外,ISM5939的安全性比直接STING激动剂要好。
Alex首席执行官Alex,论文通讯作者,英硅智能创始人。根据Zhavoronkov的说法,这项研究表明,将生物学、计算科学和AI驱动的药物发现与设计深度结合,为肿瘤免疫治疗提供了全新的可能。希望ISM5939的研发过程能给行业带来启发,促进新一代创新药物的发现,释放STING靶向疗法的潜力,进一步为免疫治疗带来更多新的选择。
赞一个
更有众多热门

















