高效靶向智能反应抗肿瘤药物输送取得新进展
高效率、精确的药物交付是新药研究和精确医疗的关键。然而,现有的药物交付策略在改善肿瘤治疗效果和治愈后仍面临巨大挑战,主要受靶向性、精确释放和肿瘤免疫抑制微环境等因素的影响。
近日,中国科学院兰州化学物理研究所天然药物与化学测量研究所海军人才团队与新疆大学合作,针对传统抗肿瘤药物输送系统的局限性,开发了一种“高效靶向刺激响应智能响应抗肿瘤药物的光热协同递送材料。《胶体与界面科学杂志》发表了相关论文。
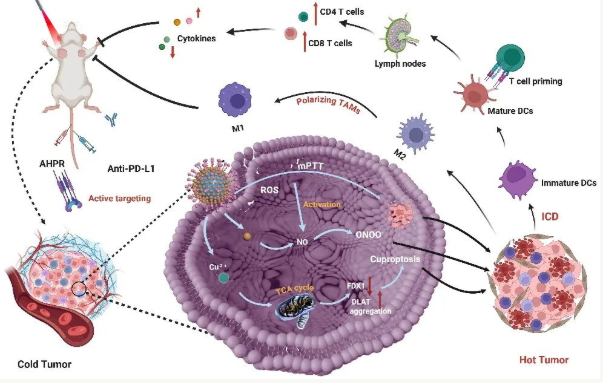
传统化疗药物的疗效往往受到靶向性不足和释放失控的限制。针对这一问题,研究团队创造性地将一氧化氮供体L-精氨酸承载在具有近红外光响应特性的中空硫化铜纳米颗粒上,构建直径240纳米的智能传递媒介。该系统可以通过表面修饰肿瘤靶向肽RGD来主动识别肿瘤组织的特异性标志,从而实现药物在疾病位置的高效聚集。测试数据显示,在近红外光的精确照射下,药物靶向效率比传统疗法高4.7倍,对正常组织的非特异性损害明显减少。
该系统的创新核心在于多种治疗系统的协同作用。当红外激活时,空心硫化铜纳米颗粒产生柔和的光热效应,促进肿瘤血管扩张和透水性增强,为药物深度渗透开辟通道。同时,纳米载体逐渐降解释放铜离子,触发肿瘤细胞独特的“铜死亡”通道。更值得注意的是,一氧化氮和活性氧/氮物种(ROS/RNS)协同飓风对肿瘤微环境造成了多重打击。这种“化学动力学-光热-气体治疗”的立体攻击,使肿瘤体积减少90%,治疗效果远远超过单一治疗模式。
研究小组首次通过莹光-光声双模态成像技术完全揭示了该系统的疗效链。在三阴性乳腺癌动物模型中,智能媒体不仅实现了药物精确的时空控制和释放,还通过诱导抗原细胞死亡,将原本“沉默”的冷肿瘤转化为免疫活跃的“热肿瘤”。
联合免疫检查点抑制剂治疗后,肿瘤微环境发生显著变化:树突状细胞成熟度增加3倍,杀伤性T细胞浸润密度增加2.8倍,M2型巨噬细胞向抗肿瘤M1型转化率达到76%,具有免疫抑制作用。这种“化疗-光热-免疫”的三维联动为打破肿瘤免疫逃逸机制提供了创新的范式。
论文作者兰州化学研究所研究员宅多隆表示,该研究构建了一个集智能交付、多模态治疗和免疫调节于一体的诊疗平台,特别适用于三阴性乳腺癌等难治性肿瘤。作者景泉博士表示,该团队已经启动了系统的生物安全评估,初步的毒理学研究表明,主要器官没有明显的损坏。
这一结果得到了国家自然科学基金和中国科学院重点部署项目的支持,申请了三项国家发明专利。其转化应用有望重塑肿瘤治疗模式,为患者带来更准确、更安全的治疗选择。
赞一个
更有众多热门

















