研究表明,热量限制可以诱发线粒体DNA缺失神经退行
近日,中国科学院广州生物医学与健康研究所研究员刘兴国团队与暨南大学教授陈功团队合作。研究表明,热量限制可以通过控制内质网-线粒体接触引起钙超载,进而导致线粒体DNA缺失的神经元退行,从而导致个人早期运动功能障碍,加速癫痫进展,加剧神经退行性改变。《分子精神病学》发表了相关结果(Molecular Psychiatry)。
线粒体DNA突变或缺失是癫痫、神经退行性疾病等多种脑部疾病的重要遗传基础,但由于缺乏合适的动物和细胞模型,发病机制研究和靶向治疗发展受到限制。此前,热量限制在神经疾病中表现出抗癫痫、降低神经变性等缓冲作用,但目前尚不清楚它是否适用于线粒体相关的神经疾病。
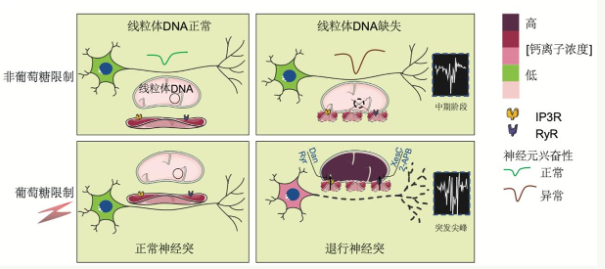
首先,研究团队通过PHP.EB将单纯疱疹病毒1型蛋白UL12.5送入小鼠大脑,特别诱导大脑内线粒体DNA缺失。数据显示,该模型的小鼠有典型的线粒体癫痫表,如严重的癫痫样发作和增强的脑电活动。在机制研究中,团队构建了线粒体DNA缺失的多能干细胞来源神经元模型,发现模拟热量限制的2-脱氧葡萄糖(2-DG)对线粒体DNA缺失神经元进行处理,表现为细胞活力下降、突触标记物减少、轴突断裂等。
超分辨率成像和钙成像显示,线粒体钙超载和内质网钙库枯竭在2-DG处理下。然而,使用胞内钙螯合剂和内质网钙通道抑制剂可以显著逆转神经元,这证明这一过程依赖于内质网-线粒体钙的异常强化转移。在体内实验中,进一步发现禁食会显著加重线粒体DNA缺失小鼠的癫痫和神经炎症,而内质网钙通道抑制剂2-APB干预可以缓解这种情况。
通过RyRy两个通道,内质网-线粒体接触距离20纳米。、IP3R将钙离子从内质网传递给线粒体,调节能量产生;然而,接触距离的异常缩短导致钙转运失控,驱动神经元退行。”论文通讯作者刘兴国表示,本研究首次构建了线粒体癫痫的人神经元细胞和老鼠双模型,揭示了内质网和线粒体之间钙转移异常导致热量限制环境下神经退行的新途径,为了了解线粒体癫痫的病理机制提供了重要的基础,也为精准营养干预和新药开发提供了理论依据和实验工具。
这项研究还警告了线粒体相关疾病患者“限制饮食热量”的临床干预方案。
赞一个
更有众多热门

















