研究人员揭示了人类甜味受体的结构和功能机制
上海科技大学iHuman研究所研究员华甜和刘志杰团队系统揭示了甜味受体的结构类型、激动剂组合模式和潜在激活机制,为了了解甜味感知提供了关键的分子基础,也为新的人工甜味剂和靶向甜味受体的药物研发策略提供了新的思路。6月24日,相关研究在《自然》上以“加快浏览”的形式在线发表。
追求甜味是人类与生俱来的本能。甜味刺激不仅可以激活大脑的“奖励系统”,还可以参与血糖调节和能量消耗的过程。甜味的感知始于舌头味蕾中特定味蕾细胞表面的味蕾受体,但甜味受体不仅分布在口腔味蕾细胞中,而且广泛存在于肠道、胰腺等组织中,是治疗代谢性疾病的重要潜在目标。
研究发现,甜味受体是由TAS1R2和TAS1R32亚基组成的异源二聚体,属于G蛋白偶联受体。(GPCRs)家中C类成员,但其三维结构信息及甜味分子对受体的调控机制长期未被系统揭示。
研究小组通过引进不同类型的荧光蛋白,成功分析了TAS1R2-TAS1R3没有配体的甜味受体表达能力低、稳定性差等困难。(apo)三维精细结构与三氯蔗糖相结合。
总体而言,TAS1R2和TAS1R32亚基都有典型的C类GPCR结构类型,其中包括捕蝇草结构域。(VFTD)、它含有半胱氨酸结构区域(CRD)以及七次跨膜结构域(TMD)。在这两种情况下,甜味受体呈现出不对称的构象,其中TAS1R2的VFTD更倾向于“关闭”,而TAS1R3的VFTD则处于“开放”状态。三氯蔗糖通过氢键、极性和疏水相互作用,特别地结合在TAS1R2亚基的VFT结构区域,结合受体的关键残基。
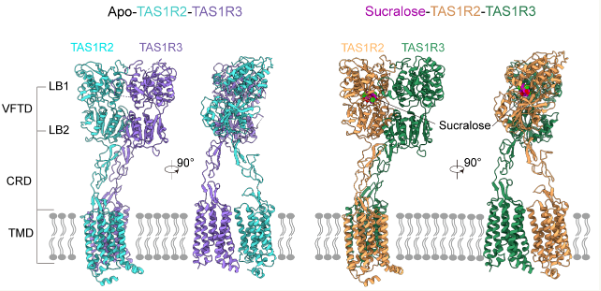
进一步,研究小组开发了一种针对甜味受体的细胞水平药学检测方法,验证了参与三氯蔗糖分子相互作用的关键残基功能,探索了蔗糖和纽甜和甜味受体的结合。结果表明,虽然三种甜味素都与TAS1R2亚基中的相同口袋相结合,但它们与受体形成的实际相互作用是不同的,这揭示了甜味素“甜度强弱”背后的分子机制。
值得注意的是,在apo和三氯蔗糖结合状态下,研究人员发现,三氯蔗糖结合仅诱导甜味受体发生小幅变化,而在其他C类GPCR激活过程中,通常伴有大规模的构象重排。与此同时,TAS1R3CRD中的一段环状结构插入两个亚基VFTD之间,促进了两个亚基之间的协同变构,提醒甜味受体可能有独特的激活机制。该团队还结合AlphaFold3对甜味受体和G蛋白gustducin的复合物模型进行了预测。
赞一个
更有众多热门

















